Eğitim Hizmetleri
Bioİzmir bünyesinde sağlık alanında ürün geliştirme süreçlerine ilişkin kurum içi ve kurum dışı talepler doğrultusunda farklı eğitimler organize edilmektedir.
Ayrıca her yıl düzenli gerçekleştirilen eğitim ve kurslar bulunmaktadır.
Eğitim konularımıza örnekler:
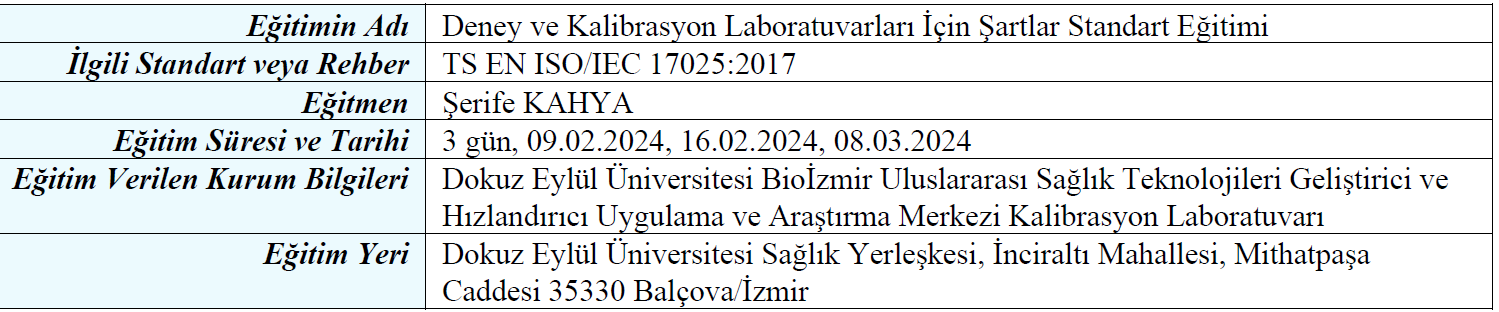
1-TS EN ISO/IEC 17025 Standart Eğitimi
2-Ölçümlerin İzlenebilirliği ve Ölçüm Belirsizliği (Kalibrasyon Laboratuvarları)
3-Tıbbi Cihaz Üretiminde Risk Yönetimi
4- Tıbbi Cihazlarda Klinik Araştırma
5-Tıbbi Cihazlarda CE Belgelendirme Süreci
Güncel Eğitim Programı